인간은 태어난 순간부터 서서히 늙어간다. 이 단순한 사실은 수천 년 동안 철학자와 과학자의 질문을 자극해 왔다. 하지만 현대 생명과학은 이제 '노화'를 단순한 운명이 아니라 세포 수준에서 해석할 수 있는 정교한 생물학적 과정으로 바라본다. 노화는 단지 주름이 생기고 머리가 희어지는 외적 변화가 아니라, 세포 속 수많은 분자적 상호작용이 서서히 흐트러지며 균형을 잃는 결과다. 세포는 처음에는 완벽한 조화 속에 작동하지만, 시간이 흐르면서 복제 오류, 에너지 손실, 염증 반응이 축적되고, 결국에는 조직과 기관 전체의 기능 저하로 이어진다. 즉, 노화는 세포의 시계가 느려지고 멈춰가는 과정이라 할 수 있다.
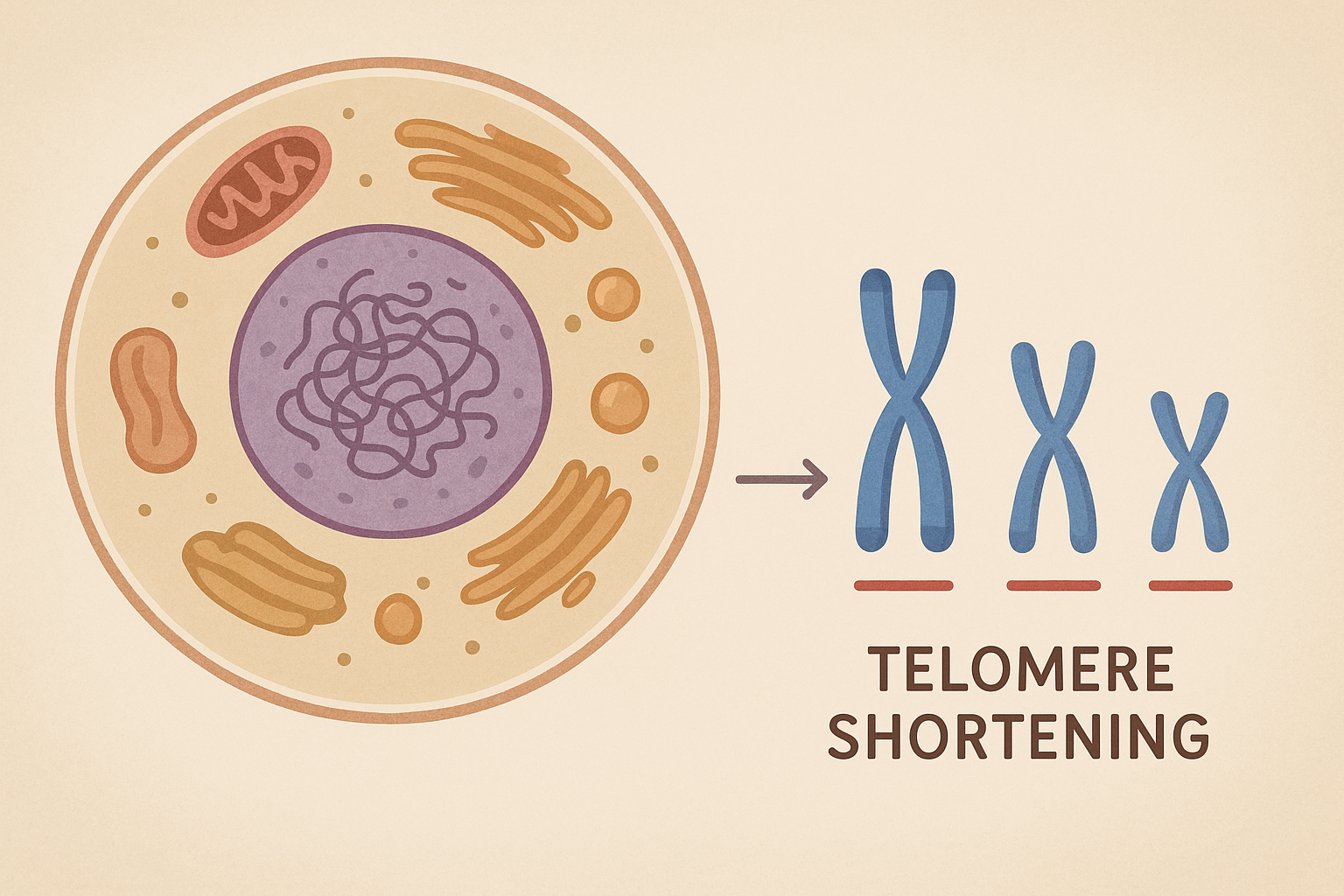
노화 연구의 출발점은 세포 분열의 한계에서 찾을 수 있다. 인간의 세포는 무한히 분열할 수 없으며, 일정 횟수 이상 복제가 이루어지면 분열을 멈춘다. 이를 ‘헤이플릭 한계’라 부른다. 그 중심에는 염색체 말단에 위치한 텔로미어라는 구조가 있다. 텔로미어는 유전 정보를 보호하는 일종의 완충 장치로, 세포가 한 번 분열할 때마다 조금씩 짧아진다. 텔로미어가 한계점에 다다르면 세포는 더 이상 복제할 수 없게 되고, 결국 노화 상태로 전환된다. 이러한 복제 노화는 인체의 전반적인 노화 속도를 결정하는 중요한 생물학적 시계 역할을 한다. 흥미롭게도, 예를 들어 줄기세포나 암세포는 텔로머라아제 효소를 통해 텔로미어를 재생함으로써 ‘세포 불멸성’을 획득한다. 하지만 그 대가는 종종 통제 불가능한 성장, 즉 암의 발생이다.
세포 내에서는 끊임없이 에너지가 만들어지고, 단백질이 합성되며, 노폐물이 제거된다. 이러한 정교한 대사 과정의 부산물로 활성산소가 생성된다. 활성산소는 정상적인 대사 산물이지만, 과도하게 축적되면 DNA, 단백질, 세포막을 손상시켜 세포 기능을 저하시킨다. 이를 산화 스트레스라고 부르며, 노화의 주요 촉매 중 하나로 알려져 있다. 젊을 때는 항산화 효소가 활성산소를 효과적으로 제거하지만, 나이가 들수록 방어 체계가 약화되어 손상이 누적된다. 이런 미세한 손상들이 쌓이면 신경세포의 기능 저하, 근육 위축, 면역력 감소 등 전신의 기능적 쇠퇴로 이어진다.
최근에는 세포 노화가 노화의 핵심 원인으로 주목받고 있다. 세포 노화란 세포가 더 이상 분열하지 않지만 살아남아 염증 신호를 분비하는 상태를 말한다. 이 노화 세포들은 주변의 정상 세포에도 영향을 미쳐 조직의 기능을 저하시킨다. 즉, 몸속의 '노화된 세포'가 일종의 독소처럼 작용하는 셈이다. 이러한 세포들이 축적되면 만성 염증 반응이 유발되고, 이로 인해 관절염, 당뇨, 심혈관 질환, 신경퇴행성 질환 등이 발생하기 쉬워진다. 이에 대한 해결책으로 과학자들은 노화 세포만을 선택적으로 제거하는 '세놀리틱' 물질 연구를 진행 중이다. 동물 실험에서는 이러한 약물을 투여한 개체가 조직 기능을 회복하고 수명이 연장되는 결과를 보였다. 언젠가 인간에게도 적용될 수 있다면, 이는 '노화 치료'라는 새로운 의학 패러다임의 서막이 될 것이다.
한편, 미토콘드리아의 기능 저하 역시 노화의 핵심 요인으로 꼽힌다. 미토콘드리아는 세포의 에너지 공장으로, ATP를 생산해 생명 활동을 유지시킨다. 그러나 세월이 흐르며 미토콘드리아 DNA가 손상되고 효율이 떨어지면 에너지 생산이 줄어들고 활성산소 발생이 늘어난다. 이로 인해 세포는 스스로의 손상을 더 가속화하게 된다. 이러한 현상은 특히 에너지 소모가 많은 뇌와 근육에서 두드러지며, 기억력 감퇴나 근력 감소 같은 전형적인 노화 증상으로 이어진다.
또 하나의 중요한 관점은 후성유전학이다. DNA 염기서열 자체는 변하지 않지만, 유전자 발현을 조절하는 메틸화 패턴이나 히스톤 변형이 나이에 따라 변한다. 이런 후성유전학적 변화는 세포의 정체성을 흔들고, 복구 능력을 떨어뜨린다. 흥미롭게도, 이러한 변화를 분석하면 생물학적 나이를 정량화할 수 있는데, 이를 '에피제네틱 시계'라 부른다. 이 시계를 통해 실제 나이보다 더 늙은 세포, 혹은 젊은 세포를 판별할 수 있으며, 이는 향후 개인 맞춤형 노화 관리나 항노화 치료의 기반이 될 가능성이 높다.
노화는 또한 조직 간 신호 전달의 불균형과도 밀접하게 연관되어 있다. 젊은 생체에서는 호르몬, 성장인자, 면역 신호가 정밀하게 조율되어 세포의 성장과 복구를 지원한다. 그러나 나이가 들면 이러한 신호 전달 경로가 왜곡되고, 세포는 외부 자극에 둔감해진다. 예를 들어, 인슐린 신호가 저하되면 포도당 대사가 비효율적으로 변하고, 이는 대사 질환과 노화가 서로를 강화하는 악순환을 만든다. 또한, 노화한 조직에서는 자가포식 기능이 감소하여 손상된 단백질과 세포소기관이 제대로 제거되지 않는다. 결국 세포는 점점 더 '오염된 환경' 속에서 작동하게 되고, 이는 조직의 기능적 퇴화를 가속한다.
현대 생물학은 노화를 피할 수 없는 운명으로 보지 않는다. 오히려 조절할 수 있는 생리적 현상으로 바라본다. 실제로 칼로리 제한, 규칙적인 운동, 충분한 수면, 정신적 안정, 그리고 항산화 식단은 세포 수준의 대사를 개선하고 노화 속도를 늦출 수 있음이 여러 연구에서 증명되고 있다. 세포 내 에너지 균형을 감지하는 AMPK, 단백질 합성과 성장에 관여하는 mTOR, 유전자 복구와 대사 조절을 담당하는 시르투인 등은 모두 노화 조절의 중심축이다. 이 신호 경로들을 적절히 조절함으로써 세포의 젊음을 유지할 수 있다는 가능성이 제시되고 있다. 특히 mTOR를 억제하는 약물인 라파마이신은 동물 실험에서 수명을 연장시켰으며, 사람을 대상으로 한 임상 연구도 활발히 이루어지고 있다.
결국 노화는 단순히 '시간이 흐른 결과'가 아니라, 세포의 조화로운 시스템이 서서히 흐트러지는 과정이다. 세포는 태어날 때부터 정교한 시계를 품고 있으며, 그 시계의 속도는 유전, 환경, 스트레스, 생활 습관, 심리적 요인까지 복합적으로 영향을 받는다. 미래의 생명과학은 이 시계를 인위적으로 조율하는 기술을 개발하여, 단순히 오래 사는 것이 아니라 '젊고 건강하게' 오래 사는 시대를 열어갈 것이다.
'생물학' 카테고리의 다른 글
| 우리 몸을 지키는 정교한 방어 체계 (0) | 2025.11.12 |
|---|---|
| 세포주기와 세포사멸이 맞물려 만드는 생명의 질서 (0) | 2025.11.11 |
| 변화 속에서 항상성을 유지하는 생명의 위대한 설계 (0) | 2025.11.11 |
| 세포가 소통하는 방식 (0) | 2025.11.10 |
| 세포로부터 시작된 생명 (0) | 2025.11.09 |



